Furano
| Furano | |
|---|---|
 | |
| Nombre IUPAC | Furano (u oxol) |
| Otros nombres | Furfurano, óxido de divinileno |
| Fórmula empírica | C4H4O |
| Masa molecular | 68,08 g/mol |
| Estado físico/Color | Líquido/Incoloro a marronoso |
| Número CAS | 110-00-9 |
| Propiedades | |
| Densidad | 0,94 g/cm3 a 20 ºC |
| Punto de fusión | -85,6 °C (187,6 K) |
| Punto de ebullición | 31,3 °C (304,4 K) |
| Solubilidad en agua | 10 g/l a 25 ºC |
| Información de Seguridad | |
  | |
| Frases R: R45, R12, R20/22, R38, R48/22, R52/53, R68 Frases S: S53,S45,S61 | |
| Exenciones y Referencias1 2 3 | |
El furano es uncompuesto orgánicoheterocíclico. Es un líquido claro, incoloro, altamente inflamable y muy volátil, con un punto de ebullición cercano al de la temperatura ambiente. Es tóxico y puede sercarcinógeno.
La aromaticidad del furano se debe a que uno de los pares de electrones solitarios delátomo de oxígeno se deslocaliza sobre el sistema de orbitales π del anillo, creando un sistema aromático de 4n+2 electrones (similar al del benceno). La estabilización extra debida a la aromaticidad comporta, por definición, una estructura plana. El otro par de electrones sin compartir del átomo de oxígeno se extiende en el plano del sistema anular, hacia fuera.
La hidrogenación del furano mediante catálisis heterogénea, esto implica uncatalizador metálico, conduce al tetrahidrofurano.
Industrialmente el furano se obtiene mediante la descarbonilación catalítica delfurfural.
Síntesis
Otro método, es la síntesis de Paal-Knorr que consiste en la deshidrataciónmediante P2O5 (o P4010) de un compuesto 1,4-dicarbonílico dando lugar al heterociclo furano.
Reacciones
Debido a la deslocalización del par de electrones del átomo de oxígeno por el anillo, π-excedente, el furano es más reactivo frente a la sustitución electrófila aromática que el benceno. No es resistente a los reactivos ácidos concentrados que se usan en la química del benceno para efectuar la sulfonación y nitración.
El furano tiene carácter de dieno en la reacción de Diels-Alder, reaccionando con dienófilos pobres en electrones.
En condiciones suaves, en medio acuoso acidificado, el furano hidroliza dando lugar al correspondiente compuesto 1,4-dicarbonílico. Sería la reacción inversa a la de Paal-Knorr.
Aplicaciones
Se usa principalmente como intermedio en la producción industrial de tetrahidrofurano.
Se utiliza en la producción de lacas, como disolvente para resinas y en la síntesis de productos químicos para la agricultura (insecticidas), estabilizantes y productos farmaceúticos (química fina).
Es útil también para sintetizar nitrofuranos, un grupo de fármacos con actividad antibacteriana, antituberculosa e incluso antitumoral.
Determinados azúcares en disoluciones, no se encuentran en sus formas de cadena abierta ya que dicha conformación no es tan estable, energéticamente hablando, como la forma cíclica que es la que se observa mayoritariamente. Estos anillos se forman gracias a que entre un aldehído y un grupo alcohol puede formarse un enlace hemiacetal.
Por ejemplo; en la glucosa (una aldosa) su C1 aldehído reacciona con un grupo hidroxilo del C5 formando un hemiacetal intramolecular. El anillo resultante de seis carbonos se denomina piranosa por su parecido con el pirano.
Otro ejemplo es la fructosa (una cetohexosa); el grupo ceto del C2 puede formar un hemiacetal intramolecular con el hidoxilo del C6 (formando un anillo de 6 miembros) o con el hidroxilo del C5 (formando un anillo de 5 miembros) dando origen a unafructopiranosa o a una fructofuranosarespectivamente (gracias biochemistryquestions por la corrección).
A las representaciones de los anillos de furanos y piranos se las denomina proyeccciones de Haworth; en ellas no se representan los átomos de carbono explícitamente, el plano sería prependicular al papel, con la línea más gruesa proyectada hacia el mismo. Laconfiguración α indica que el grupo hidroxilo del C1 está anclado en el lado opuesto del CH2OH del carbono que determina si el azúcar es D o L. La configuración β es aquella en la que el grupo hidroxilo está en el mismo lado que el CH2OH del centro quiral. Al C1 se le denomina carbono anomérico y a las formas α y β:anómeros. Estas formas se encuentran en nuestro cuerpo siguiendo la siguiente relación:
1/3 α
2/3 β
1% en forma de cadena abierta
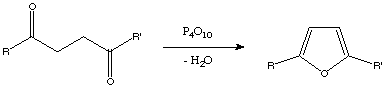

No hay comentarios:
Publicar un comentario